Sommaire
La Recherche Clinique comprend l'ensemble des essais cliniques effectués chez l'Homme qui permettent :
- soit de tester de nouveaux médicaments (ou dispositifs médicaux) en vue d'une Autorisation de Mise sur le Marché (AMM) : c'est la Recherche Clinique Industrielle,
- soit de comparer des stratégies de soins existantes ou des techniques de diagnostic existantes, afin de les optimiser ou de les harmoniser : c'est la Recherche Clinique Institutionnelle.
Le but de ces recherches est d'apporter de nouvelles perspectives thérapeutiques ou d'apporter un bénéfice par rapport à l'état actuel des connaissances, pour les diverses pathologies dont souffrent les patients.
Quelles sont les différences entre la Recherche Clinique Industrielle et la Recherche Clinique Institutionnelle ?
Au cours de la Recherche Clinique Industrielle , les essais cliniques sont financés par les laboratoires pharmaceutiques. Ce sont les laboratoires pharmaceutiques qui initient ces recherches et qui en sont légalement responsables. On dit qu'ils sont "Promoteurs". Ces essais cliniques visent à tester chez l'homme de nouveaux médicaments afin d'obtenir une autorisation de commercialisation ou bien une extension d'indication thérapeutique pour un médicament déjà commercialisé.
Dans la Recherche Clinique Institutionnelle , les essais cliniques sont financés par des appels d'offres d'Etat, par des associations (ANRS, Sidaction…etc) ou par un soutien financier de l'industrie pharmaceutique. Ce sont des médecins, des hôpitaux ou des institutions publiques (Délégation Régionale à la Recherche Clinique, par exemple) qui sont promoteurs. Ces essais cliniques ont plusieurs axes de recherche. Majoritairement, ils ont pour but de comparer des stratégies de soins existantes ou des techniques de diagnostiques existantes afin de les optimiser ou d'apporter un consensus dans le milieu médical et ce, dans plusieurs domaines d'application. Ils ont également une importance capitale en thérapie cellulaire et génique, notamment dans la prise en charge des maladies rares ou orphelines.
Comment développe-t-on un nouveau médicament?
Le développement d'un nouveau médicament est un processus très long et très coûteux. C'est la raison pour laquelle il est presque exclusivement pris en charge par un laboratoire pharmaceutique, dans le cadre de la recherche industrielle.
La Recherche Pré-Clinique : avant les tests sur l'Homme
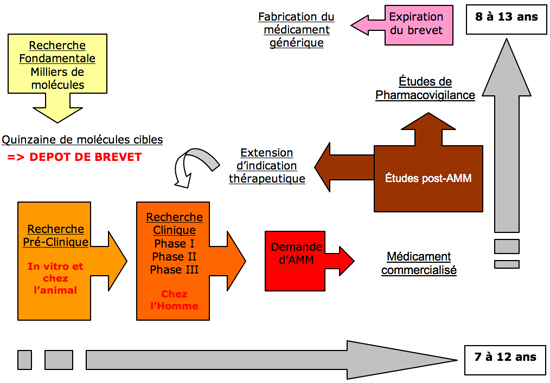
Sur des milliers de molécules sélectionnées en tant que nouveaux médicaments potentiels en recherche fondamentale, les tests de laboratoire identifient environ une quinzaine de molécules candidates pour la phase de recherche pré-clinique. Cette phase permet de définir, in vitro puis chez l'animal, les propriétés physico-chimiques de la molécule, sa toxicité et son devenir dans l'organisme animal (absorption, métabolisme, distribution par la circulation sanguine, élimination). Cette étape peut prendre plusieurs années.
La Recherche Clinique : les tests sur l'Homme
Après l'évaluation de ces molécules chez l'animal et après autorisation des Autorités Compétentes (AC), quelques unes d'entre elles sont alors étudiées chez l'Homme.
La recherche clinique est constituée de 3 phases d'étude :
- La phase I permet de terminer les tests pré-cliniques, en évaluant chez un petit nombre de volontaires « sains » la tolérance et le devenir de la molécule dans l'organisme humain.
- La phase II permet de définir chez un petit groupe de patients homogènes, l'efficacité de la molécule, la dose optimale à administrer lors de la phase III des tests et les interactions médicamenteuses potentielles.
- Enfin la phase III permet dévaluer à grande échelle (plusieurs centaines de patients) l'efficacité et la tolérance de la molécule grâce à des essais comparatifs avec un placebo ou un traitement de référence. Le principe des essais comparatifs repose sur l'attribution aléatoire des traitements et le principe du double aveugle.
A l'issue de la phase III, la détermination de la tolérance et de l'efficacité de la molécule permettent d'évaluer son rapport bénéfice/risque . A ce stade, le dossier d'AMM est constitué. Finalement, seules une ou deux molécules arrivent à l'ultime étape de commercialisation en tant que nouveau médicament.
La Recherche sur le nouveau médicament ne s'arrête pas là. Des études de phase IV sont réalisées dans les conditions habituelles d'emploi, après la commercialisation du produit, et permettent de poursuivre la surveillance d'effets indésirables potentiels ainsi que de son efficacité sur des milliers de personnes.
Des extensions d'indications pour un médicament commercialisé peuvent également être demandées mais doivent, bien entendu, refaire l'objet de nouvelles phases de test chez l'homme.
La Recherche Industrielle : schéma récapitulatif
Quel est le rôle des hôpitaux dans la Recherche Clinique ?
Le rôle des hôpitaux (mais aussi des cabinets médicaux de ville) est de faciliter le recrutement des patients pour participer aux essais cliniques.
Plus un service est reconnu pour la qualité de ses soins, l'importance de son activité (nombre de patients suivis) et son expérience de la Recherche Clinique, plus il sera sollicité pour participer à des essais cliniques. Les hôpitaux ou cabinets de ville choisis pour recruter des patients à inclure dans des essais cliniques sont appelés Centres Investigateurs. Pour être centre investigateur, il faut également répondre à des normes en termes de locaux, de matériel, de disponibilité de personnels, vérifiées à l'aide d'un Questionnaire de Faisabilité Préalable.
Quel est le personnel impliqué dans la Recherche Clinique ?
Les médecins
On les appelle les médecins investigateurs. Ce sont les seules personnes à pouvoir proposer aux patients de participer à un essai clinique. Ils doivent répondre à un certain nombre d'exigences réglementaires et doivent être déclarés aux Autorités Compétentes. Ils doivent avoir une connaissance de la réglementation des essais cliniques et connaître les essais cliniques en cours dans leur centre. Ils assurent le suivi médical des patients inclus dans les essais cliniques selon le protocole de surveillance prédéfini et sont chargés de leur sécurité.
Les Attachés de Recherche Clinique (ARC)
Ce sont les personnes qui aident les médecins investigateurs à gérer le côté pratique des essais cliniques dans le centre. Ils connaissent parfaitement la réglementation des essais cliniques. Ils veillent à ce que chaque recherche se déroule selon le protocole pré-établi et validé par les autorités compétentes, dans le respect de la réglementation et des droits du patient. Ils sont les contacts privilégiés des promoteurs, du personnel médical impliqué dans la recherche et des patients.
Le personnel infirmier
Il est très impliqué dans les essais cliniques. Il aide à la réalisation et/ou à la préparation aux examens, nécessaires pour le protocole. Il est en permanence au contact du patient et transmet régulièrement et rapidement aux médecins investigateurs et aux attachées de recherche clinique toute information importante concernant le patient.
